
题目列表(包括答案和解析)
氨是最重要的化工产品之一。
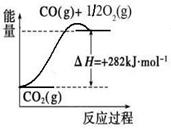
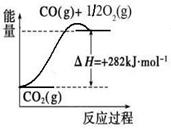
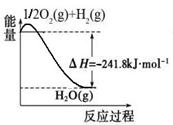
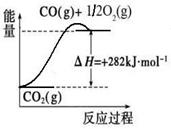
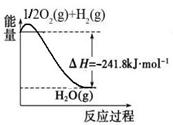
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。



(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。

(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
|
弱电解质 |
H2CO3 |
NH3·H2O |
|
电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
(15分)氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。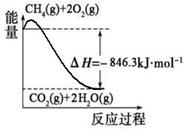

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g)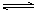 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。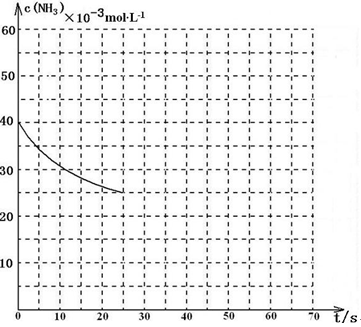
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。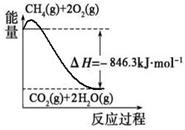
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。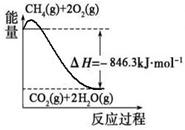
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0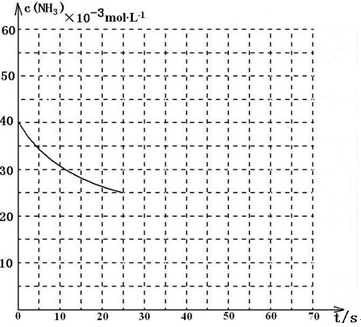
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
过氧化物在日常生活与工农业生产中应用广泛。如:过氧化氢是一种常见的绿色氧化剂,过氧碳酸钠、过氧化尿素则是多功能、高效、广谱的固体消毒剂。
资料显示:过氧化氢是一种无色液体,属于二元弱酸,能与水、乙醇、乙醚以任意比混溶,易分解,且重金属离子 对其分解过程具有促进催化作用。
(1)写出过氧化氢在Fe3+存在条件下分解的化学反应方程式:____________________;过氧化氢可作为绿
色氧化剂的理由是_______________。
(2)某同学为验证H2O2具有弱酸性,在滴加有酚酞的NaOH稀溶液中,加入适量的H2O2,结果发现溶液的红色褪去。你认为能否通过该实验证明H2O2具有酸性,并说明理由________________。如何通过实验进一步证明褪色的真正原因?请写出具体的实验方法:________________。
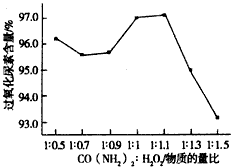
(3)过氧化尿素是一种新型的氧化剂与消毒剂,由H2O2与尿素在30℃反应制得。如图是30℃时过氧化尿素合成过程中原料的物质的量配比对产品含量的影响;你认为实际生产中应将n(H2O2):n[CO(NH2)2]控制在
____________,出现这一实验结果的主要原因是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com