
题目列表(包括答案和解析)
(13分)
Ⅰ.下图所示是分离混合物时常用的仪器,回答下列问题: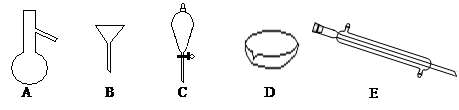
(1)写出仪器A、C、E的名称
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)食用油和酒精: 汽油和水:
Ⅱ.实验室用固体烧碱配制200 mL 0.5 mol·L-1的NaOH溶液。
(1)需称量_________ g 烧碱,应放在___________中称量、溶解。
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有___________
(3)请描述定容操作应采取的具体方法_____________________________。
(13分)
Ⅰ.下图所示是分离混合物时常用的仪器,回答下列问题:
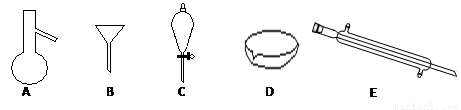
(1)写出仪器A、C、E的名称
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)食用油和酒精: 汽油和水:
Ⅱ. 实验室用固体烧碱配制200 mL 0.5 mol·L-1的NaOH溶液。
(1)需称量_________ g 烧碱,应放在___________中称量、溶解。
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有___________
(3)请描述定容操作应采取的具体方法_____________________________。
(2)20 mL 1 mol·L-1的NaCl和40 mL 0.5 mol·L-1 CaCl2混合后的溶液中,Cl-的物质的量浓度是_________。
(3)在标准状况下,700 L NH3的物质的量为_________,全部溶解在1 L水中,所得溶液的质量分数为_________,如果该氨水的密度为0.85 g·cm-3,则氨水的体积为_________ L,物质的量浓度为_________。
(4)已知质量分数为37%的浓盐酸的密度为1.19 g·cm-3,该盐酸的物质的量浓度为_________。配制200 mL 0.5 mol·L-1盐酸溶液需要该浓盐酸_________mL。
(5)常温下,相对分子质量为M的某无水盐A的溶解度为S g,则常温时,该盐饱和溶液的质量分数为_________,如果已知该饱和溶液的密度为ρ g·cm-3,则该溶液的物质的量浓度为_________。
实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ( )
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是____________________。
(3)容量瓶上除有刻度线外还应标有_________________,容量瓶在使用前必须进行的一 步操作是_________________________。
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
(11分)实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ( )
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是____________________。
(3)容量瓶上除有刻度线外还应标有_________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com