
题目列表(包括答案和解析)
为了实现下列各变化,需还原剂物质的是: ( )
A.KClO3→O2 B.NH4+→NH3 C.Fe→FeCl3 D.CO2→CO

| ||
| ||
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用Na2CO3溶液处理过的口罩(湿润);⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
据报道,为防止罐中液氯再次泄漏,4月1日抢救人员将盛液氯的罐吊到事故发生地附近刚挖好的水塘中,用烧碱溶液处理。写出反应的离子方程式____________________________。
(2)用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代,生成含氯的有机化合物,对人体有害,世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱高效消毒剂二氧化氯(ClO2)。
我国最近研究成功了用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是______________,在H2SO4的酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,在以上反应中NaClO3和Na2SO3的物质的量之比为_______。
(3)一化学课外活动小组的同学制作了一种家用环保型消毒液发生器(如图1-3-3),用石墨作电极电解饱和氯化钠溶液,可制得少量消毒剂。为了研究各电极的产物,反应开始后沿玻璃管滴几滴酚酞试液到溶液中,发现上层溶液变红,一段时间后,红色消失。则与电源a端相连的电极上发生的电极反应式为____________________。

图1-3-3
该小组同学经查阅资料后认为褪色的原因可能有两个:一是氢氧化钠浓度过大;二是。小华设计了一个简单的实验,只需要一种试剂,便获得了有关褪色原因的结论,请简要写出小华设计的实验方案:______________________________________________________________。
(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
(1)下列有关O4的说法正确的是________
A、O4分子内存在极性共价键B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中________(填序号)相当于氧分子的还原.

(3)化合物O2[PtF6]中含有O![]() ,有一种常见的含有O
,有一种常见的含有O![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
(Ⅱ)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势.
回答下列问题:
⑴江苏省大气污染特征是________
A、煤烟型B、机动车尾气型C、由煤烟型向煤烟型与机动车尾气混合型转化
D、由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵某研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究.
①如果你参加该课题的探究,在讨论测定地点时,你建议选择的地点分别是________.
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫.变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________.
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
HCHO+H2SO3→![]()
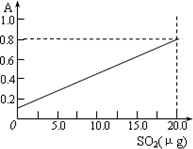
该反应类型属于________.测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量.实验测得SO2含量与溶液的吸光度A的关系如右上图所示.若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________.
I.纯碱、烧碱等是重要的化工原料。
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| ② | | |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com