
题目列表(包括答案和解析)
 实验室需用98 ml 1.0 mol/L 硫酸,现用浓硫酸(标签如下图)配制。实验仪器有:A.25 ml量筒 B.托盘天平 C.玻璃棒 D.50 ml容量瓶 E.10 ml量筒 F.胶头滴管 G.50 ml烧杯 H.100 ml容量瓶 I.200 ml容量瓶
实验室需用98 ml 1.0 mol/L 硫酸,现用浓硫酸(标签如下图)配制。实验仪器有:A.25 ml量筒 B.托盘天平 C.玻璃棒 D.50 ml容量瓶 E.10 ml量筒 F.胶头滴管 G.50 ml烧杯 H.100 ml容量瓶 I.200 ml容量瓶
(1)实验时应选用的仪器是(填入编号)_________。
(2)所需浓硫酸的体积是________ml。
(3)下列错误操作可使所配制溶液浓度偏高的是
A.容量瓶洗涤后未干燥
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
右图为实验室某浓硫酸酸试剂瓶标签上的有关数据,
|
(1)该浓硫酸的物质的量浓度为 。
(2)使用容量瓶前必须进行的一步操作是___________
(3)某学生欲用上述浓硫酸和蒸馏水配制500 ml 物质的量
浓度为1.0 mol·L-1稀硫酸。
①该学生需要量取 ml 上述浓硫酸进行配制。
②容量瓶上需标有以下五项中的
A温度 B浓度 C容量 D压强 E刻度线
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?
(在后面横线上“偏高”、“偏低”、“无影响”)。
I、用量筒量取浓硫酸时俯视凹液面
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ、定容时仰视视刻度线
Ⅳ、转移时容量瓶中有少量蒸馏水
欲用质量分数为98%的浓硫酸(ρ=1.84 g/cm3)配制成浓度为0.5 mol/L的稀硫酸500 mL.
(1)选用的主要仪器有________.
(2)请将下列各操作,按正确的序号填在横线上.
A.用量筒量取一定体积的浓H2SO4
B.反复颠倒摇匀
C.加蒸馏水至距刻度2~3 cm时,改用胶头滴管加水至刻度
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液一并转移至容量瓶,摇匀
E.在烧杯中稀释浓H2SO4
F.静置,待溶液恢复至室温后,将溶液转入容量瓶
G.将所配溶液转移至洁净干燥的试剂瓶,并贴上标签
其操作正确的顺序依次为________.
(3)简要回答下列问题:
①所需浓硫酸的体积为________mL.
②如果实验室有15 mL、20 mL、50 mL的量筒应选用________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取会使浓度________.
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并不断搅拌的目的是________,若搅拌过程中有液体溅出会使浓度偏________.
④在转入容量瓶前烧杯中液体应________,否则会使浓度________;并洗涤烧杯2~3次,洗涤液也要转入容量瓶,否则会使浓度________.
⑤定容时必须使溶液凹液面与刻度相平,若俯视结果会使浓度________;仰视则使浓度________.
(08长沙雅礼中学一模)(16分)某课外实验小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
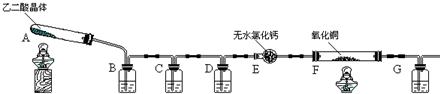 |
(1)装置C中盛放 溶液;D的作用是 ;
(2)证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出 ;
(4)某同学查阅相关资料:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。因此该同学认为:需要在装置B之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(5)草酸可以在酸性条件下被KMnO4氧化,反应的离子方程式为:
2MnO4- + 5H2C2O4 +6 H+ = 2Mn2+ +10 CO2↑+8 H2O
实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取2.680 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,将锥形瓶置于 (填“酸式” “碱式”)滴定管下,用KMnO4溶液滴定。当 时,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 |
滴定管 液面刻度 | 0.00 mL | 20.02 mL | 21.00mL | 19.98 mL | 20.00mL |
KMnO4溶液的物质的量浓度的是c(KMnO4)= mol?L-1。
(12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com