
题目列表(包括答案和解析)
氮是地球上极为丰富的元素.填写下列空白.
(1)NH![]() 中N原子的杂化轨道类型为________,
中N原子的杂化轨道类型为________,
NH![]() 的空间构型为________.
的空间构型为________.
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:________,Li3N晶体属于________晶体(填晶体类型).
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:________.
(4)CO与N2相似,分子中都存在一个共价叁键,CO含________个π键.下表为CO与N2的相关信息.根据表中数据,说明CO比N2活泼的原因:________.

(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式________.
![]()
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:

①基态Fe原子的未成对电子数有________个,
写出Cr、Cu+的价层电子排布式.________、________.
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:________,接受孤对电子的离子是:________,用箭号标出[Cu(NH3)2]+形成的配位键:________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取________杂化与NH3形成配位键(填杂化类型).
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是________分子(填“极性”或“非极性”).
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定.
①氮化硅晶体属于________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:________.
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________.
考生必须从中选择1道题作答。
1.【化学—化学与技术】金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是___________________。
(2)电解生成的金属铝是在熔融液的______________(填“上层”或“下层”)。
(3)阴极和阳极均由______________材料做成;电解时不断消耗的电极是___________(填“阳极”或“阴极”)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成______________(填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
2.【化学—物质结构与性质】
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式______________。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______________。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______________,微粒间存在的作用力是______________。
(3)氧化物MO的电子总数与SiC的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_________________________。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键。___________。
3.【化学—有机化学基础】
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。

请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。
 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,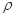 、NA的计算式表示)
、NA的计算式表示).已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
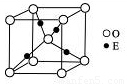
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com