
题目列表(包括答案和解析)
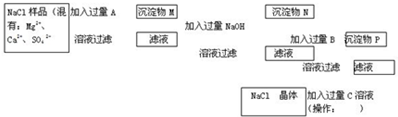

(Ⅰ)某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)
操作Ⅱ必须用到的仪器是________.(填编号)
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式___________________,
加入氨水要过量的原因是__________________________.
(3)检验沉淀是否已经洗涤干净的操作是_____________________________
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是________________________.
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是________(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是________________________________.(写出一种原因即可).
(Ⅱ)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量.下面是在形同的室温下对该产品的两个探究实验:
实验1:向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1.
①1.0 mol镁条、0.10 mol铁粉、0.10 mil氯化钠粉末;
②将1.0 mol镁条剪成100份、0.10 mol铁粉、0.10 mil氯化钠粉末;
③1.0 mol镁粉、0.10 mol铁粉、0.10 mil氯化钠粉末;

实验2:向加有100 mL水的隔热容器中分别加入0.10 mol镁粉、0.50 mol铁粉及不同量的氯化钠粉末,不断搅拌,第15 min时记录温度升高的幅度参见上图2.
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是________.
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________.
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060 mol NaCl,则第15 min时混合物的温度最接近于________.
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是______________________________________.


CoCl2·6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:①钴与盐酸反应的化学方程式为:Co+2HCl![]() CoCl2+H2↑
CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为________________.
(2)加入碳酸钠调节pH至a,a的范围是________.
(3)操作Ⅰ包含3个实验基本操作,它们依次是________和过滤.
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是________________.
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________.
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行________操作.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com