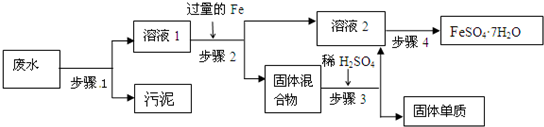
某试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图进行实验:

(1)请写出步骤①中发生的全部反应的离子方程式
FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
(2)请写出步骤③中发生的全部反应的离子方程式
Fe+Cu2+=Cu+Fe2+;Fe+2H+=Fe2++H2↑.
Fe+Cu2+=Cu+Fe2+;Fe+2H+=Fe2++H2↑.
.
(3)若全部的溶液Y和全部的粉末Z充分反应生成不溶物W的质量为32g,气体F在标准状况下体积为5.6L,所得溶液的体积为200mL,则每份试样X的质量
56g
56g
g,所得溶液E中Fe
2+的物质的量浓度为
5mol/L
5mol/L
mol/L.