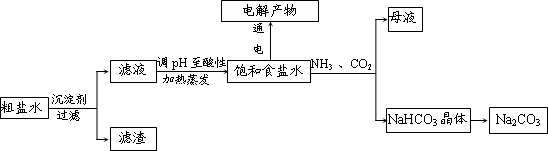
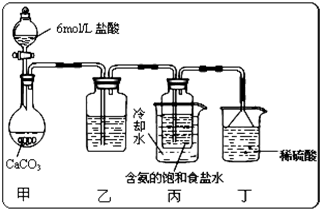
(2012?河北区一模)研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)
2+CaCl
2+2H
2SO
42CaSO
4+2Cl
2↑+2H
2O.他们设计了如下制取氯气并验证其性质的实验.
试回答:(1)该实验中A部分的装置是
b
b
(填写装置的序号).
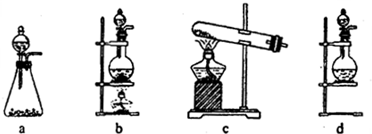
(2)(1)选项中d装置的两个主要的玻璃器皿的名称分别是
分液漏斗
分液漏斗
、
圆底烧瓶
圆底烧瓶
.
(3)请你设计一个实验,证明洗气瓶C中的Na
2SO
3已经被氧化(简述实验步骤):
取适量实验后的洗气瓶C中的溶液,加过量盐酸无沉淀产生,再滴加氯化钡溶液,
如产生白色沉淀,则证明洗气瓶C中的Na2SO3已经被氧化
取适量实验后的洗气瓶C中的溶液,加过量盐酸无沉淀产生,再滴加氯化钡溶液,
如产生白色沉淀,则证明洗气瓶C中的Na2SO3已经被氧化
.
(4)分别写出C装置、D装置发生反应的离子方程式
Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O或HCO3ˉ+Cl2=HClO+CO2↑+Cl-
Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O或HCO3ˉ+Cl2=HClO+CO2↑+Cl-
.
(5)该实验存在明显的缺陷,请你从化学反应的视角提出改进的方法是
在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中
在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中
.所发生反应的化学方程式是
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H
2SO
4溶液,静置.待完全反应后,用0.1mol/L的Na
2S
2O
3溶液作标准溶液滴定反应生成的碘,已知反应方程式为:
2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI 反应完成时,共用去Na
2S
2O
3 20.0mL.则该漂白粉中Ca(ClO)
2的质量分数为
35.75%
35.75%
.(保留至0.01%)



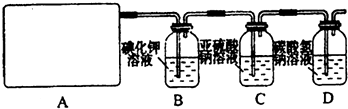
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是