
题目列表(包括答案和解析)
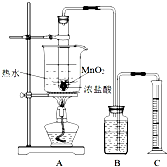 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |

| ||
| △ |
| ||
| ||
| △ |
| ||

| 实验序号 | H2O2溶液 质量分数% |
H2O2溶液 用量/毫升 |
物质D用量(g) | 反应温度(℃) | 收集气体 体积/毫升 |
所需时间(秒) |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
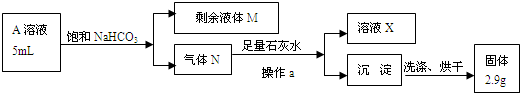
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。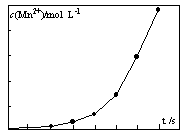
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com