
题目列表(包括答案和解析)
| A、红热的铁丝在氯气里剧烈燃烧,生成棕褐色的烟 | B、通常情况下,干燥的氯气能与Fe反应 | C、纯净的H2能在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状,H2和Cl2的混合气体光照时,迅速化合而爆炸 | D、有大量的氯气泄露时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
A.红热的铜丝在氯气里剧烈燃烧,生成棕色的烟
B.通常情况下,干燥的氯气能和Fe反应
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状,H2和Cl2的混合气体光照时,迅速化合而爆炸
D.氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸
绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴 试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是 。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
【问题2】灼烧绿矾的反应方程式:2(FeSO4·7H2O) Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题:
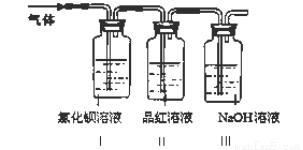
(1)装置I中氯化钡溶液中可观察到现象 。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是
(3)装置III中试剂为NaOH溶液,其作用是 。
(12分)高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解
实验室以软锰矿(主要成份是MnO2)为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:
![]()
第二步是在通入CO2条件下使+6价的锰歧化为+7价和+4价(MnO2)。
实验流程如下: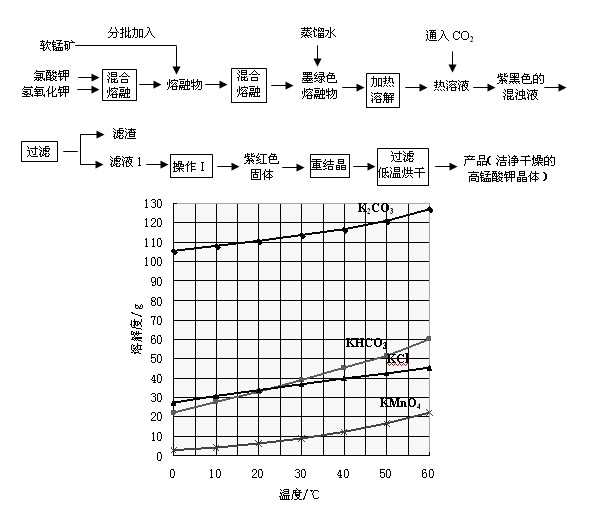
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1)下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是
A.蒸发皿 B.玻璃棒 C.铁棒 D.坩埚 E.泥三角 F.烧杯 G.酒精灯 H.铁坩埚
![]()
(2)通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
![]()
(3)通入适量的二氧化碳直到锰酸钾全部岐化为止(可用玻璃棒蘸取溶液点于滤纸上,如果滤纸上只有紫红色而无绿色
痕迹,即表示锰酸钾已歧化完全),二氧化碳的通入量不能过多的原因是 。
![]()
(4)操作Ⅰ应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理由是 。(5)除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外(歧化法),通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反为 。
与歧化法相比,电解法主要的优点是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com