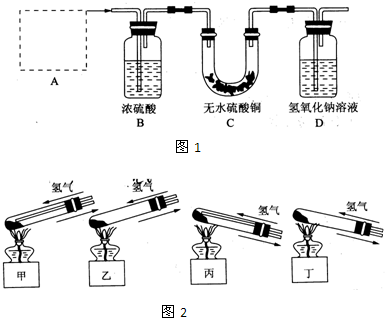
Ⅰ、铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题.
(1)A处应选用图2装置中的(填写编号)
丙
丙
(铁架台已省去),选用的理由是①
因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净.
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
称量装置D(含氢氧化钠溶液)的质量
称量装置D(含氢氧化钠溶液)的质量
;反应进行时,应先
通氢气
通氢气
再
加热
加热
;实验过程中,观察到试管中固体颜色变化为
固体由绿色变黑色,最后变成光亮的红色
固体由绿色变黑色,最后变成光亮的红色
.
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
在D装置后加一个盛有碱石灰的球形干燥管
在D装置后加一个盛有碱石灰的球形干燥管
.
Ⅱ、10℃时加热NaHCO
3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO
3-的水解程度增大,故碱性增强,该反应的离子方程式为
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.乙同学认为,溶液pH升高的原因是NaHCO
3受热分解,生成了Na
2CO
3,并推断Na
2CO
3的水解程度
大于
大于
(填“大小”或“小于”)NaHCO
3.丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
乙
乙
(填“甲”或“乙”)判断正确.试剂X是
B
B
(填序号).
A.Ba(OH)
2溶液 B.BaC1
2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
甲
甲
(填“甲”或“乙”)判断正确.
(3)查阅资料,发现NaHCO
3的分解温度为150℃,丙断言
乙
乙
(填“甲”或“乙”)判断是错误的,理由是
常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
.