(2012?长春三模)硫酸厂用煅烧黄铁矿(FeS
2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe
2O
3及少量FeS、SiO
2)制备绿矾.
(1)SO
2和O
2反应制取SO
3的反应原理为:2SO
2+O
22SO
3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:
.
②该反应达到平衡状态的标志是
BD
BD
.
A.v(SO
2)=v(SO
3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
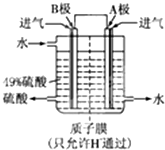
(2)某科研单位利用原电池原理,用SO
2和O
2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为
SO2-2e-+2H2O═SO42-+4H+
SO2-2e-+2H2O═SO42-+4H+
;
②溶液中H
+的移动方向由
B
B
极到
A
A
极;
电池总反应式为
2SO2+O2+2H2O═2H2SO4
2SO2+O2+2H2O═2H2SO4
.
(3)利用烧渣制绿矾的过程如下:
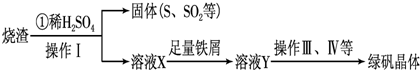
测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO
4溶液滴定至终点,消耗KMnO
4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
5
5
Fe
2++
1
1
Mn+
8
8
H+
H+
--
5
5
Fe
3++
1
1
Mn
2++
4
4
H2O
H2O
②用硫酸酸化的KMnO
4滴定终点的标志是
滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色
滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色
.
③计算上述产品中FeSO
4?7H
2O的质量分数为
0.975或97.5%
0.975或97.5%
.


