
题目列表(包括答案和解析)
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
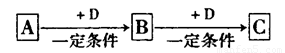
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
| +D |
| 一定条件 |
| +D |
| 一定条件 |
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com