
题目列表(包括答案和解析)
A.升高温度 B.加入适量的水
C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
 NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表.
NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表. 
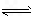 I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态). 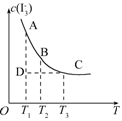
|
下列关于氯水和氨水的说法中正确的是 : | |
A. |
氨水中存在3种分子,分别是:H2O、NH3、NH3·H2O |
B. |
等体积、等浓度的氨水和醋酸溶液混合所得溶液呈中性,说明CH3COONH4不水解 |
C. |
氯水中存在3种离子,分别是:H+、Cl―、OH― |
D. |
在饱和氯水中加入CaCO3,可以得到浓度较大的次氯酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com