某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验,回答下列问题.
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为
.
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN
-的浓度为0.2000mol?L
-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H
2SO
4,关闭活塞.
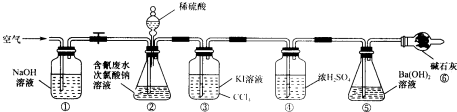
已知装置②中发生的主要反应依次为:
CN
-+ClO
-═CNO+Cl
-2CNO
-+2H
++3ClO
-═N
2↑+2CO
2↑+3Cl
-+H
2O
(2)装置③的作用是
,装置⑥的作用是
.
(3)反应结束后,缓缓通入空气的目的是
.
(4)为计算该实验中含氰废水被处理的百分率,需要测定
的质量.
(5)上述实验完成后,为了回收装置③中的CCl
4需要的操作是
.
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
| 实验 |
c(H2SO4)mol.L-1 |
V(H2SO4)mL |
V(NaClO)mL |
含氯废水的体积mL |
| 1 |
|
100 |
|
100 |
| 2 |
0.0500 |
|
100 |
100 |
| 3 |
0.2000 |
|
100 |
100 |


 过氧化氢很重要的研究和应用价值.
过氧化氢很重要的研究和应用价值.

