
(2009?广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(1)精制过程中反应的离子方程式为
Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
.
(2)电解过程的总反应方程式为
.
(3)电解槽阳极产物可用于
制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)
制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)
(至少写出两种用途).
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| NaOH/g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
| NaCl/g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为
蒸发
蒸发
、
浓缩
浓缩
.脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是
蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解)
蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解)
.

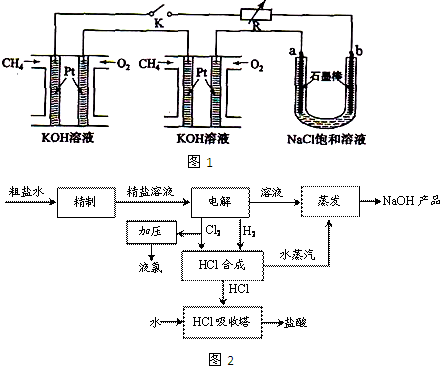

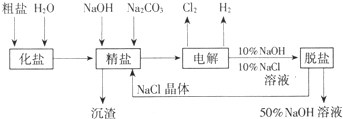 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图: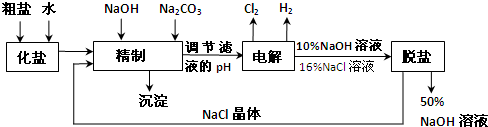
 (2009?广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(2009?广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下: