(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
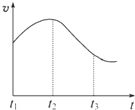
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl
3的同浓度工业稀盐酸中,发现放出氢气量减少.
实验三、将不纯的锌片与稀盐酸反应,发现反应速率加快.
实验四、在盐酸中滴入几滴CuCl
2溶液,同样生成氢气速率加快.
问题:
(1)试分析实验一中t
1~t
2速率变化的主要原因是
纯锌与稀盐酸反应,放出热量,温度升高
纯锌与稀盐酸反应,放出热量,温度升高
,t
2~t
3速率变化的主要原因是
随着反应进行c(H+)降低
随着反应进行c(H+)降低
.
(2)实验二放出氢气量减少的原因是
锌片与FeCl3反应,导致与盐酸反应的锌的质量减少
锌片与FeCl3反应,导致与盐酸反应的锌的质量减少
.
(3)某同学认为实验三和四反应速率加快原因,均因为原电池的存在,你认为是否正确,若不正确,说明原因.若正确写出原电池的电解质溶液、正、负极材料及电极反应.
|
负极材料 |
正极材料 |
负极反应式 |
正极反应式 |
电解质溶液 |
| 实验三 |
Zn |
杂质 |
Zn-2e-=Zn2+ |
2H++2e-=H2↑ |
盐酸 |
| 实验四 |
Zn |
Cu |
Zn-2e-=Zn2+ |
2H++2e-=H2↑ |
盐酸 |
|
负极材料 |
正极材料 |
负极反应式 |
正极反应式 |
电解质溶液 |
| 实验三 |
Zn |
杂质 |
Zn-2e-=Zn2+ |
2H++2e-=H2↑ |
盐酸 |
| 实验四 |
Zn |
Cu |
Zn-2e-=Zn2+ |
2H++2e-=H2↑ |
盐酸 |
.

 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
