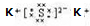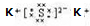A、B、C、D是同一周期的4种元素,A、B、C的原子序数依次相差为1,A元素的单质化学性质活泼.A元素原子半径在本周期中最大.2.00g B元素的氧化物恰好和100mL 0.50mol?L
-1稀硫酸完全反应.B元素的单质跟D元素单质反应生成化合物BD
2.试回答:
(1)写出A、B、C、D 4种元素最高价氧化物对应水化物的化学式,并按碱性逐渐减弱,酸性逐渐增强的顺序加以排列:
NaOH、Mg(OH)2、Al(OH)3、HClO4
NaOH、Mg(OH)2、Al(OH)3、HClO4
.
(2)写出下列反应的离子方程式:
①将C的氧化物投入到A的氧化物的水化物中:
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.
②将C的氧化物投入到D的氢化物的水溶液中:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.
(3)B的单质投入沸水中反应的化学方程式:
Mg+H2O(沸水)═Mg(OH)2+H2↑
Mg+H2O(沸水)═Mg(OH)2+H2↑
.