
题目列表(包括答案和解析)
|
下列微粒的核外电子排布式所表示的粒子一定属于短周期元素的是 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1)Zn2+在基态时核外电子排布式为____ _。
(2)SO42-的空间构型是___ __(用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3、CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是___ __(不定项选择)。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为_____。
③NO能被FeS04溶液吸收生成配合物[(Fe(NO)(H20)5)S04,该配合物中心离子的配位数为_____(填数字)。
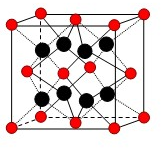
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=_____(填数字)。

 (PAN)等二次污染物。
(PAN)等二次污染物。
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为 。ACl3分子的空间构型为 。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,

该同学所画的电子排布图违背了 。
(3)A、B、C三元素原子第一电离能由大到小的顺序为 (用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为 。
(4)D的基态原子有 种能量不同的电子;D2+ 的价电子排布式为 。已知D晶体中微粒的堆积方式为面心立方堆积,晶体中一个晶胞的边长为a cm,则D晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数的值)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com