
题目列表(包括答案和解析)
| 放电 | 充电 |
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极______________________________________________,
负极:_______________________________________________________________。
③工作时电池正极区的pH________(填“增大”、“减小”或“不变”)。
(2)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是1/2H2+NiO(OH) 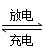 Ni(OH)2。
Ni(OH)2。
电池放电时,负极是____________,负极的电极反应式为_________,正极的电极反应式为___________,正极附近溶液的pH如何变化?______________。
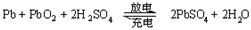 请回答下列问题:
请回答下列问题:有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
某一学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示装置,则电源电极名称和消毒液的主要成分判断正确的是( )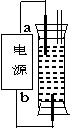
A.a为正极,b为负极;NaClO和 NaCl
B. a为负极,b为正极;NaClO和 NaCl
C. a为阳极,b为阴极;HClO和 NaCl
D. a为阴极,b为阳极;HClO和 NaCl
在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C. 原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的PH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A.27mg B.54mg C.108mg D.216mg
钢铁发生电化学腐蚀时,负极发生的反应是( )
A.2H++2e- → H2 B.2H2O+O2+4e- → 4OH-
C.Fe-2e- → Fe2+ D.4OH--4e- → 2H2O+O2
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的PH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被氧化
D.电池放电时,H2是负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com