
题目列表(包括答案和解析)
通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引 起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH一=HCO3- HCO3-+OH一=CO32一+H2O
CO32-+H+反应生成CO2分两步:
第一步:CO32-+H+= HCO3- 第二步:HCO3- +H+=CO2↑+ H2O
(1)目前,用超临界CO2( 其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对保护环境的作用是 。
(2)最近有科学家提出“绿色自由’’构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇。其流程如下:

①写出CO2与H2反应制得甲醇的化学方程式: 。
②某同学在实验室用下图所示的装置和药品制取K2 CO3溶液,他所制得的溶液中可能含有的杂质是
。

③某同学在数字化实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成溶液,然后逐滴加人相同浓度的稀硫酸,测得如下数据:

则该混合固体中K2CO3与KHCO3的物质的量之比是 ;所用硫酸的物质的量浓度为 。
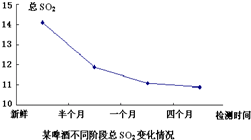 二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.
二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.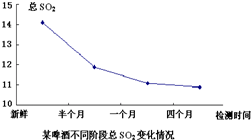 二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.
二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
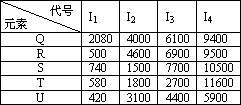
(1)在周期表中,最可能处于同一族的是________.
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是________.
A.S2+ B.R2+ C.T3+ D.U+
(3)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明________________,如果U元素是短周期的元素,你估计它的第二次电离能飞跃是发生在失去第________个电子时.
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素S的第一电离能异常高的原因是________________.

| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com