
题目列表(包括答案和解析)
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)B和F的最高价氧化物对应的水化物中酸性较强的是 (填化学式),写出可以验证该结论的一个离子方程式 。
(2)AE的水溶液可用于刻蚀玻璃,反应的化学方程式为 。
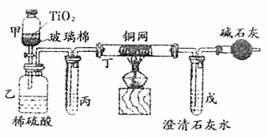 (3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml?L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
(3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml?L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
回答下列问题:
①乙中反应的离子方程式为
。
②乙中生成的气体除C2和BD2外,还有HC1及副产物C12等,上述实验是通过测定BD2的量来确定BC-的处理效果。则丙中加入的试剂是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
③戊中盛有过量的澄清石灰水,若实验结束后戊中共生成沉淀0.82g,则该实验中测得BC-被处理的百分率为 。
④某同学对上述实验进行全面的分析后,得出测定结果比实际结果偏低的结论。你认为此结论 (填“正确”或“不正确”)
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:

(1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。
(2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体

(14分)下表为一元素周期表(空白,未填元素)根据要求填空。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ② | ③ | ④ |
|
|
| ⑤ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 丙 |
|
| 丁 |
| 甲 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 乙 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴ 在上面元素周期表中,全部是金属元素的区域为 (填字母代号)
A.甲 B.乙 C.丙 D.丁
⑵用实线画出金属与非金属的分界线(在答题卷图上完成)。
⑶已知R元素的某种原子的质量数为31,且原子核内质子数比中子数少1,请在答题卷中的周期表中标出“R” 元素的位置(在答题卷图上完成)。
⑷在我们常用的周期表中,①元素的位置比较尴尬,它是第1列的唯一非金属元素。有人认为也可把①元素放在VIIA族,支持这个观点的物质是___ _______。
A.HF B.H+ C.NaH D.H2O2
⑸由①②③④四种元素形成的原子个数比为5:1:1:3一种离子化合物的化学式为__ ____;该化合物与过量⑤的氧化物的水化物微热时反应的离子方程式是 ;
若用球棍模型表示①和④形成的化合物的分子结构,应该是 。
(14分)下表为一元素周期表(空白,未填元素)根据要求填空。
| ① | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | ② | ③ | ④ | | |
| ⑤ | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | 丙 | | | 丁 |
| 甲 | | | | | | | | | | | | | | | | | |
| | | | | | | 乙 | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com