
题目列表(包括答案和解析)
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析 出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
2.从右图曲线中可以分析得到KNO3和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① |
溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m1) |
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m2) |
⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO3和2d0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl-的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是

(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
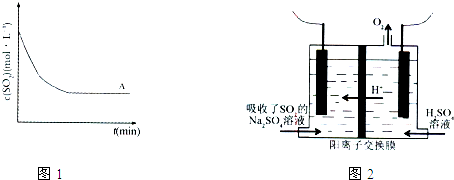
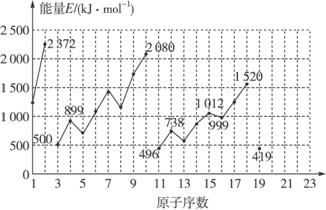
图1-5
(1)同主族内不同元素的E值的变化特点是_______________。各主族中E值的这种变化特点体现了元素性质的____________变化规律。
(2)同周期内,随原子序数的增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是___________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:____________<E<____________。
(4)10号元素E值较大的原因是____________________________________。
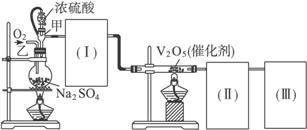
图1-3

图1-4
(1)根据实验的需要,(Ⅰ)(Ⅱ)(Ⅲ)处应连接合适的装置,从图1-4的A、B、C、D、E中选择合适的装置,将其序号填入以下空格内。(Ⅰ)(Ⅱ)(Ⅲ)所处连接的装置分别为____________________,____________________,____________________。
(2)实验时,浓硫酸能顺利地滴入烧瓶中,甲仪器起作用的原理是____________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时,在加热与滴加浓硫酸过程中,应采用的操作是____________________。
(4)用在火加热烧瓶时,SO2的转化率会____________________(填“提高”“不变”或“降低”)。
(5)用a mol粉末与足量浓硫酸进行此实验,当反应结束后,继续通入O2一段时间后,称得装置(Ⅲ)增重b g,则本实验中SO2的转化率为____________________。
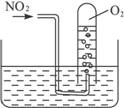
图1-2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com