
题目列表(包括答案和解析)
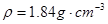 ) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。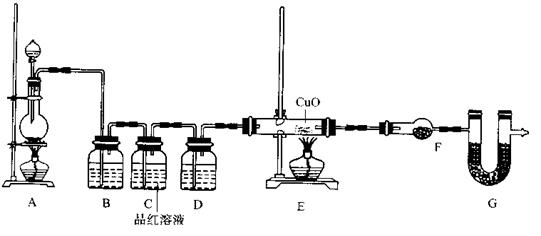
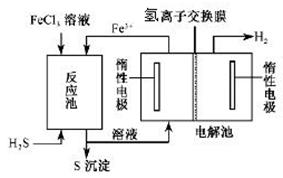
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
Ⅰ、(4分)将0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况
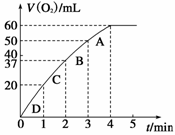 下放出气体的体积和时间的关系如图所示。解释反应速率变化的
下放出气体的体积和时间的关系如图所示。解释反应速率变化的
原因: ;计算H2O2的初
始物质的量浓度为 。(保留两位有效数字)
Ⅱ、(8分)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。
(2)若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
(3)若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,。请用p0、p来表示达平衡时反应物A的转化率а(A)为 。
(4)能够说明该反应达到平衡的标志是( )
A.容器内混合气体的密度保持不变 B.v(A)=3v(B) C.A、B的浓度之比为3:1
D.单位时间内消耗3n molA的同时生成n molB E.混合气体的平均相对分子质量
硫有多种化合物,许多含硫化合物在工业上有重要的用途.
1.工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺.
3FeS2+12C+8O2A是________(写化学式).若得到192克的硫磺,则产生标准状况下的A气体________L.
2.硫的氯化物常做橡胶工业的硫化剂.硫与氯气在一定条件下反应,得到两种硫的氯化物B和D.B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32.计算确定这两种氯化物的分子式分别为________.
3.硫化氢有毒.在120℃、101 kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数.写出推导过程.(不考虑硫化氢的分解)
4.硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得.取15.12 g Na2SO3溶于80.0 mL水中,加入5.00 g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0 mL,再冷却到10℃,则理论上析出Na2S2O3?5H2O多少克?写出推导过程.(已知:Na2S2O3的溶解度,10℃时为60.0 g/100 g水,100℃时为207 g/100 g水.100℃时,Na2S2O3饱和溶液的密度为1.14 g/mL).
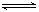 7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。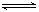 2SO3(g) ΔH =" —196.6" kJ·mol-1
2SO3(g) ΔH =" —196.6" kJ·mol-1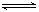 SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1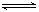 2NO2(g)的 ΔH =" _________" kJ·mol-1
2NO2(g)的 ΔH =" _________" kJ·mol-1 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L—1) | 0.9 | 1.0 | 0.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com