
题目列表(包括答案和解析)
 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答: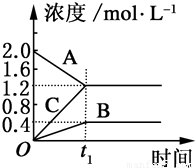
下表是A、B、C、D、E五种有机物的有关信息;
A | B | C | D | E |
①能使溴的四氯化碳溶液褪色;
③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为:
| ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应。 | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做 ;写出在一定条件下,A生成高分子化合物的化学反应方程式__ _____。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有的性质是 (填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(4) E反应能生成(C3H4O2)n的物质,该反应类型为 ;工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10![]() %,其目的是 。
%,其目的是 。
(5) 写出由C氧化生成D的化学反应方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com