
题目列表(包括答案和解析)

实验室用加热二氧化锰与浓盐酸的混合物制备氯气:
MnO2+4HCl(浓)一套完整的氯气实验室制备装置应该由四部分构成
(如图).同学们需要注意实验仪器的连接和作用.
A.分液漏斗:用来盛放液体试剂,本实验用来盛装浓盐酸.
B.圆底烧瓶:做反应容器,内放固体物质,本实验盛装的是固体二氧化锰.在加浓盐酸时要注意液体的量不能超过烧瓶容积的________,而且加热时要________,使烧瓶底部均匀受热,避免受热不均而炸裂.
C.除杂装置:第一个洗气瓶内盛有饱和食盐水,它的作用是除去氯气中混有的氯化氢杂质;第二个洗气瓶内盛有浓硫酸,用于除去氯气中混有的水蒸气.洗气瓶中两个导管的插入原则是“长进短出”.除杂的顺序是先除氯化氢,后除水蒸气.如果顺序颠倒,不能起到除杂的作用,原因是________.
D.集气装置:用来收集密度比空气大的气体要用向上排空气法.如果不需要收集干燥的氯气,也可以使用________的方法.
E.尾气吸收:因为氯气有毒,会污染环境,多余的氯气不能排放到大气中,选用________进行尾气处理.
 在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白: 图中符合该晶体溶解度曲线的是
图中符合该晶体溶解度曲线的是| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红色 红色 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为 浅黄绿色 浅黄绿色 色 |
过量氯气溶解于水中 过量氯气溶解于水中 |
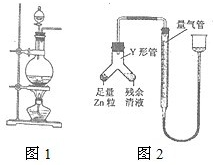 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com