
题目列表(包括答案和解析)
(12分)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
| 物质 | 杂质 | 试剂 | 化学(离子)方程式 |
| ①CO2 | HCl | | |
| ②Fe(OH)3 | Al(OH)3 | | |
| ③Cu | Mg | | |
(12分)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
|
物质 |
杂质 |
试剂 |
化学(离子)方程式 |
|
①CO2 |
HCl |
|
|
|
②Fe(OH)3 |
Al(OH)3 |
|
|
|
③Cu |
Mg |
|
|
| 物质 | 杂质 | 试剂 | 化学(离子)方程式 |
| ①CO2 | HCl | | |
| ②Fe(OH)3 | Al(OH)3 | | |
| ③Cu | Mg | | |
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
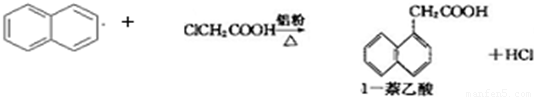
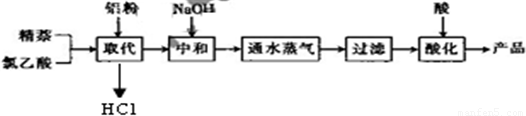
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
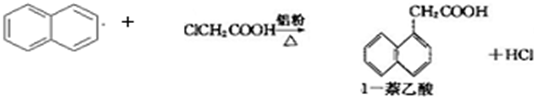
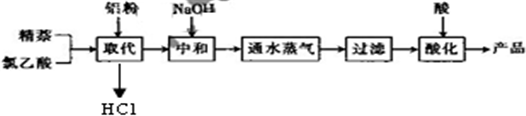
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com