
题目列表(包括答案和解析)
0.5 mol A元素的原子在反应中失去1 mol电子生成简单阳离子。0.4 g A的单质与足量盐酸反应,生成上述A的阳离子时,可放出0.02 g氢气 。通过计算确定A是什么元素。
0.5 mol A元素的原子在反应中失去1 mol电子生成简单阳离子.0.4 g A的单质与足量盐酸反应,生成上述A的阳离子时,可放出0.02 g氢气.通过计算确定A是什么元素.
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
|
|
I1 |
I2 |
I3 |
I4 |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
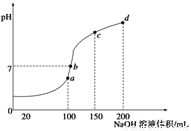
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: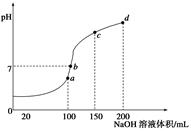
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com