Ⅰ.一定条件下铁可以和CO
2发生反应:Fe(s)+CO
2(g)

FeO(s)+CO(g);△H>0
(1)下列措施中能使平衡时
增大的是
B
B
(填序号).
A.增大压强 B.升高温度 C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO
2,则CO
2的转化率将
不变
不变
(填“增大”、“减小”、“不变”).
(3)铁的重要化合物在生产生活中应用十分广泛,高铁酸钠(Na
2FeO
4)是一种新型饮用水消毒剂.
①高铁酸钠生产方法之一是在强碱性溶液中用NaClO氧化Fe(OH)
3生成高铁酸钠、氯化钠和另一种常见化合物.现产生了66.4g高铁酸钠,转移电子数目为
1.2NA或1.2×6.02×1023
1.2NA或1.2×6.02×1023
.
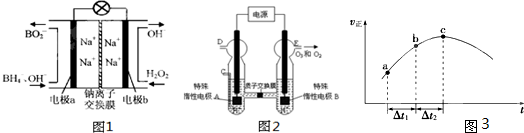
②高铁酸钠生产方法之二电解法:用隔膜式电解槽,在浓碱溶液中,经过电解,将Fe氧化成高铁酸盐.实验室中可用右图所示装置进行实验.写出阳极的电极反应式
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
Ⅱ.硝酸是一种重要的化工原料,而氨气是工业生产硝酸的重要原料.
(1)据报道用Mg与石墨作电极与NH
4Cl溶液形成原电池,也可生成NH
3.其反应是Mg+2NH
4Cl=MgCl
2+2NH
3↑+H
2↑,写出该电池正极的电极反应式
2NH4++2e-=2NH3↑+H2↑
2NH4++2e-=2NH3↑+H2↑
.
(2)硝酸厂常用碱液吸收法处理尾气:用Na
2CO
3溶液吸收NO
2生成CO
2.若每2mol NO
2和Na
2CO
3溶液反应时转移电子1mol,则反应的离子方程式是
2NO2+CO32-=NO3-+NO2-+CO2
2NO2+CO32-=NO3-+NO2-+CO2
.


 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0