
题目列表(包括答案和解析)
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作目的 |
| 步骤1 | ||
| 步骤2 | ||
| 步骤3 | ||
| 步骤4 | 洗涤沉淀 | |
| 步骤5 | 得到FeSO4溶液 |
Ⅰ.现在四种化学仪器:A.量筒 B.容量瓶 C.滴定管 D.烧杯
(1)标有“0”刻度的化学仪器为 ;(填代号 ,下同)[来源:学+科+网]
(2)实验时,要用所装液体润洗的是 ;
(3)使用前要检验是否漏水的仪器 ;
(4) 量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x<n<y,则所用的仪器为 。
Ⅱ.某实验小组欲从硫酸铜和硫酸亚铁的酸性混合溶液中分离出硫酸亚铁溶液,经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH值如下表:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:H2O2、CaO、CuO、稀H2SO4、铁粉
(1)分离实验的实验操作步骤和目的为:
|
实验步骤 |
实验操作 |
实验操作目的 |
|
步骤1 |
|
|
|
步骤2 |
|
|
|
步骤3 |
|
|
|
步骤4 |
洗涤沉淀 |
[来源:] |
|
步骤5 |
|
得到FeSO4溶液 |
(2)步骤4中需要的玻璃仪器为 、 、 ;检验沉淀洗涤干净的操作方法为 。
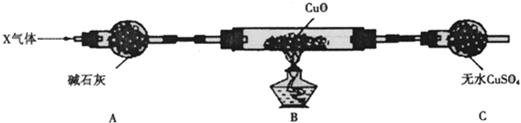
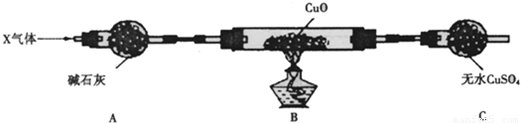

| 放电 | 充电 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com