
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
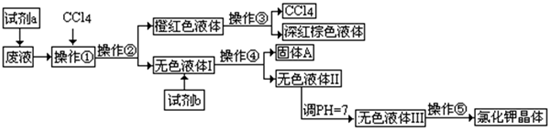
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 。
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
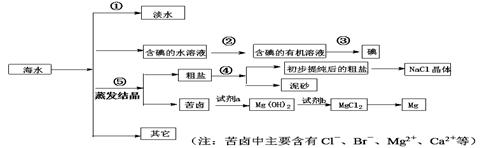
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 。
18.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com