
题目列表(包括答案和解析)
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
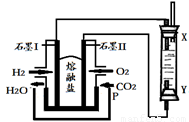
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。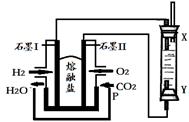
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
 O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1  CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1 Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
碳和铝是常见的还原剂。
(1)碳与铝分别在氧气中燃烧,产生非极性分子A与固体B,A的分子式是 。
(2)用NaOH溶液把(1)中的B刚好溶解后得到溶液C,然后把少量A通到C溶液中,反应后过滤可得Al(OH)3沉淀和滤液。则下列说法正确的是 (填序号)。
a.A溶于水后促进了NaAlO2的水解,产生Al(OH)3沉淀
b.A l(OH)3(胶体)能凝聚水中悬浮物,可用来净水
c.若取滤液少量,在火焰上灼烧,火焰的颜色为黄色
d.若向滤液中滴加足量硝酸酸化的AgNO3溶液,最后有沉淀产生
(3)若向溶液C中滴入Al2(SO4)3溶液也会得到Al(OH)3沉淀。该反应的离子方程式是 。
(4)碳、铝均能还原铁的氧化物。为确定混合物(FeO、Fe2O3)的组成,进行如下实验:
①取一定量混合物与足量碳粉加热,只收集到CO气体m mol;
②取与①相同量的混合物与足量铝进行铝热反应,得到单质铁n mol;
则混合物中FeO的物质的量分数是 ;②中铝的物质的量至少 mol。
下列化学反应的离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4。溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
B.氧化铁溶于过量氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
C.将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
D.稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com