
题目列表(包括答案和解析)
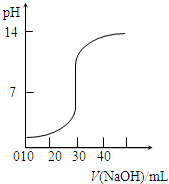 某同学进行中和滴定实验,并绘制出如图所示的滴定曲线.下列有关该实验的说法正确的是( )
某同学进行中和滴定实验,并绘制出如图所示的滴定曲线.下列有关该实验的说法正确的是( )| A、锥形瓶中盛有NaOH溶液,指示剂为酚酞 | B、滴定管使用前先用待测液润洗,再用蒸馏水润洗 | C、滴定时,应时刻注视滴定管中液面的变化 | D、滴定终点附近,测试和记录pH的间隔要小 |
下列有关实验操作或结果的说法中正确的是________(填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10 mol·L-1的KMnO4溶液15.10 mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
Ⅰ.下列有关实验操作或结果的说法中正确的是 (填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10 mol·L-1的KMnO4溶液15.10 mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
Ⅱ.(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。已知H2O(l) = H2O(g) ΔH =+44 kJ·mol-1 则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷P4和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198 kJ·mol-1 P-O 360 kJ·mol-1,氧气分子内氧原子间的(O=O)键能为498 kJ·mol-1。则P4+3O2 = P4O6的反应热ΔH为 。
Ⅰ.下列有关实验操作或结果的说法中正确的是 (填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10 mol·L-1的KMnO4溶液15.10 mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
Ⅱ.(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。已知H2O(l) = H2O(g) ΔH =+44 kJ·mol-1 则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷P4和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198 kJ·mol-1 P-O 360 kJ·mol-1,氧气分子内氧原子间的(O=O)键能为498 kJ·mol-1。则P4+3O2 = P4O6的反应热ΔH为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com