
题目列表(包括答案和解析)
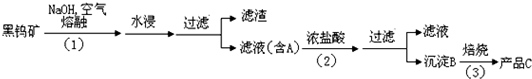
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。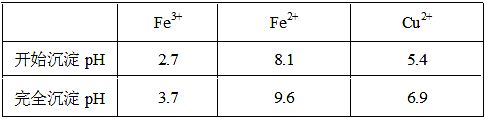
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。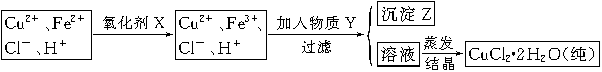
①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。

(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。

①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
②物质Y的化学式是 ;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是 ;若25℃时,a=3的溶液中,c(Fe3+)= mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com