
题目列表(包括答案和解析)
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。
(1)G的元素符号是_________原子的价电子排布图为______________
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________
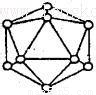
(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式)
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;

有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式 。
(2)A的单质分子中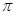 键的个数为 。
键的个数为 。
(3)A、B、C三种元素第一电离能由大到小的顺序为 (用元素符号表示)
(4)B元素的氢化物的沸点是同族元素中最高的,原因是 。
(5)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。
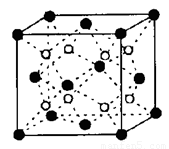
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为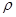 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=
cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=
cm. (用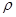 、NA的计算式表示)
、NA的计算式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com