
题目列表(包括答案和解析)
(1)聚苯乙烯材料会造成“白色污染”,是因为____________________________________。
(2)乳酸是以淀粉为原料水解成葡萄糖,再经乳酸菌发酵制得:
C6H12O6![]() 2C3H6O3。为测定乳酸的分子结构,取9.0 g乳酸进行如下实验:
2C3H6O3。为测定乳酸的分子结构,取9.0 g乳酸进行如下实验:
①跟NaOH反应,消耗了1.0 mol·L-1的NaOH溶液100 mL,由此说明________________。
②跟足量的金属钠反应,放出气体2 240 mL(标准状况下)。由此说明___________________。
③以银为催化剂跟O2反应,生成CH3COCOOH。由此说明___________________________。
(3)试写出两个乳酸分子反应生成C6H8O4的化学方程式(有机物用结构简式表示)________________。
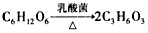 。为测定乳酸的分子结构,取9.0g乳酸进行了如下的实验:
。为测定乳酸的分子结构,取9.0g乳酸进行了如下的实验:| 1 | 2 |
乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,由乙醇制取氢气具有良好的应用前景。已知由乙醇制取氢气可有如下两条路线:
① 水蒸气催化重整:
CH3CH2OH(g)+H2O(g)====4H2(g)+2CO(g) ![]() 255.58 kJ?mol
255.58 kJ?mol![]()
② 部分催化氧化:
CH3CH2OH(g)+1/2 O2(g)====3H2(g)+2CO(g)![]() 13.76 kJ?mol
13.76 kJ?mol![]()
请回答下列问题:
(1)下列说法正确的是 。(填字母)
A.从原料消耗的角度来看,路线①制氢更有价值
B.从能量消耗的角度来看,路线①制氢更加有利
C.由于路线②制氢要消耗很多能量,故在实际生产中意义不大
D.路线①和路线②均使用催化剂,是为了降低反应所需的能量
(2)在体积为1 L的密闭容器中充入2 mol CO和4 mol H2,一定条件下发生反应:
4H2(g)+2CO(g)![]() CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g) ![]() 255.58kJ?mol
255.58kJ?mol![]()
欲使![]() (CH3CH2OH)/
(CH3CH2OH)/![]() (CO)增大,应采取措施是 。(答两项即可)
(CO)增大,应采取措施是 。(答两项即可)
(3)若用0.8lt淀粉为原料,理论上可制得质量分数为92%的乙醇溶液 t。
(4)若用乙醇得到的合成气(CO、H2的混合气)来合成一种生物汽油。乙醇按路线① 和路线② 的反应各占50%,合成气合成生物汽油的反应为:![]()
假定这种生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物,Y是烷烃。1 t质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),最终可得到X的质量为多少吨?
葡萄糖经发酵后可得乳酸,乳酸也可从酸奶中提取.纯净的乳酸为
无色粘稠状液体,易溶于水.为研究其分子结构,进行如下实验:
①取0.90g乳酸,使之汽化,并测得其密度是乙烷密度的3倍.
②将它燃烧并使产物通过碱石灰,测得碱石灰增重1.42g,当再用白色粉末 处理时,未出现蓝色;当接着将气体通入过量石灰水时,测得产生1.00g白色沉淀.向增重的碱石灰中加入足量的盐酸,收集到无色气体448mL(标准状况).
处理时,未出现蓝色;当接着将气体通入过量石灰水时,测得产生1.00g白色沉淀.向增重的碱石灰中加入足量的盐酸,收集到无色气体448mL(标准状况).
③再取0.90g乳酸与足量 反应,得到112mL无色气体(标准状况);若使同量乳酸与足量金属钠反应,则得到无色气体224mL(标准状况).
反应,得到112mL无色气体(标准状况);若使同量乳酸与足量金属钠反应,则得到无色气体224mL(标准状况).
④乳酸可跟醋酸发生酯化反应,且反应物质量之比为3∶2;乳酸又可跟乙醇发生酯化反应,且测得反应时两种物质的物质的量之比为l∶1.又知以上发生的两种酯化反应,分别发生在乳酸的链中和链端.回答以下问题:
(1)乳酸的相对分子质量为________.
(2)0.90g乳酸充分燃烧时,产物的物质的量分别是 _______mol;
_______mol; ________mol.
________mol.
(3)乳酸的分子式为________;结构简式为________.
(4)当葡萄糖发酵时只生成乳酸,试写出这一变化的化学方程式________.
(5)分别写出以下两种酯化反应的化学方程式.
①乳酸与乙酸:________.
②乳酸与乙醇:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com