
题目列表(包括答案和解析)
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
| 实验步骤 | 预期现象 |
| 步骤1:除铁.将铜粉置于烧杯中, |
|
| 步骤2:溶解.将步骤1得到的铜粉置于烧杯中, |
|
| 步骤3:结晶.将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品. | / |
| A、得到的蜡状固体可燃 | B、离子化合物在酒精中的溶解度较小 | C、硬脂酸是离子化合物 | D、提高温度可以增加硬脂酸在酒精中的溶解度 |
![]() 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。
![]() (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
![]() (2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
![]() ①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
![]() ②将上述固体置于烧杯中 。
②将上述固体置于烧杯中 。
![]() (3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
![]()
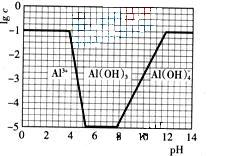
![]() ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
![]() ②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
![]()
(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
②将上述固体置于烧杯中 。
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
(11分)超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
②将上述固体置于烧杯中 。
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
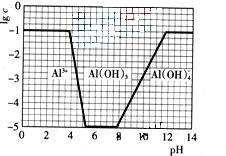
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com