
题目列表(包括答案和解析)
A.1 mol Cu与足量的浓硫酸反应
B.27 g Al与足量四氧化三铁反应
C.11.2 L(标准状况)O2与足量的镁反应
D.0.6 mol KMnO4与足量浓盐酸反应制氯气
(8分) A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答: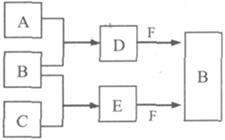
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
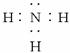
(1)写出X的名称_____________;A的电子式_____________。
(2)写出AD反应的化学方程式___________________________________________。
(3)写出C作氧化剂时的化学方程式(任写一种)_________________________________。
(4)写出N的稀溶液与过量M反应的离子方程式___________________________________。
(5)0.3 mol M与足量B反应转移电子的物质的量为____________mol。
(6)治疗心绞痛的药物三硝酸甘油酯(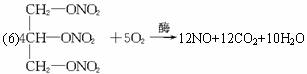 ),在人体液中酶的作用下,缓慢氧化释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式_____________________。
),在人体液中酶的作用下,缓慢氧化释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式_____________________。
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答:
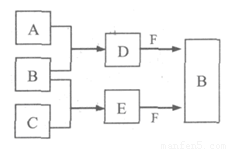
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热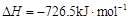 ,氢气的燃烧热
,氢气的燃烧热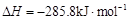 )
)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答:
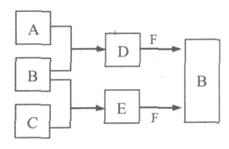
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热![]() ,氢气的燃烧热
,氢气的燃烧热![]() )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com