
题目列表(包括答案和解析)
| X | Y | |
| 第一电离能(KJ/mol) | 495.8 | 418.8 |
(14分).酸碱中和滴定是中学化学常见实验。
Ⅰ右图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ 某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol·L-1标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
|
滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
(12分) 回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 和将空气与碳反应后除去CO 2;氢气的来源是用水和碳氢化合物反应并产生CO, 写出采用天然气为原料制取氢气的化学反应方程式 。
(2)设备A中含有电加热器、触煤和热交换器,设备A中发生的化学反应方程式为 ;
(3) 设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
(计算结果保留三位有效数字)
(12分) 回答下列问题:

(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 和将空气与碳反应后除去CO 2;氢气的来源是用水和碳氢化合物反应并产生CO, 写出采用天然气为原料制取氢气的化学反应方程式 。
(2)设备A中含有电加热器、触煤和热交换器,设备A中发生的化学反应方程式为 ;
(3) 设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)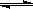 CO2 (g)+ H2
(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2
(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
(计算结果保留三位有效数字)
将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的百分比浓度为( )
A.小于50% B.大于50% C.等于50% D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com