
题目列表(包括答案和解析)
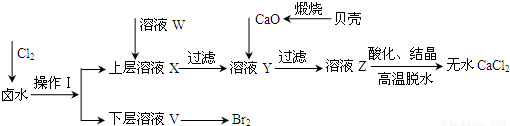
实验室以含有Ca2+、Mg2+、Cl‾、SO42‾、Br‾等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
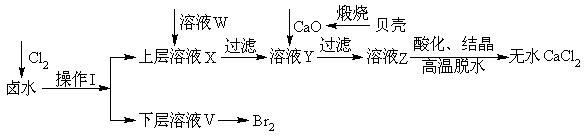
(1)操作I使用的试剂是______________,所用主要仪器的名称是__________________。
(2)加入溶液W的目的是____________________________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择pH最大范围是__________________。酸化溶液Z时,使用的试剂为____________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | C(OH‾)=1.8 mol•L‾1 |
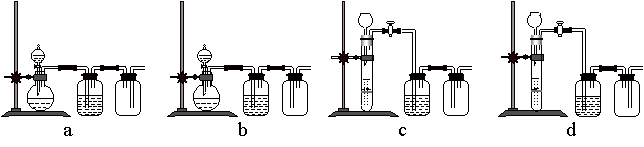
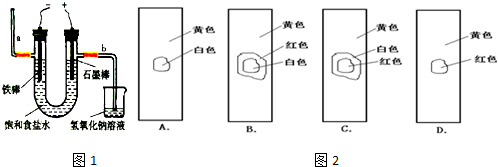
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是______。
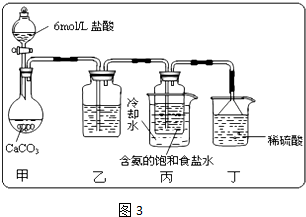
(4)常温下,H2SO3的电离常数Ka1=1.2×10‾2,Ka2=6.3×10‾8,H2CO3 的电离常数Ka1=4.5×10‾7,Ka2=4.7×10‾12。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于__________________。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论,仪器自选)。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHCO3、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、pH试纸。
_______________________________________________________________________________________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |

| ||
(1)![]() 。?
。?
(2)在室温常压下,1 mol氖气含有的原子数为![]() 。?
。?
(3)1 mol白磷分子中所含共价键数为4![]() 。
。
(4)常温常压下,![]() 个CH4分子的体积大于
个CH4分子的体积大于
(5)标准状况下,![]() 。?
。?
(6)只有在熔化时,1 mol NaCl中才含有![]() 个Cl-。
个Cl-。
(7)1 mol金刚石和1 mol二氧化硅中所含C—C键、Si—O键数目均为2![]() 。?
。?
(8)在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为![]() 。?
。?
(9)在常温常压下,![]() 。?
。?
(10)1 mol苯分子中含有的碳碳双键数为3![]() 。?
。?
(11)常温常压下,1 mol NO2气体与水在无氧条件下反应生成![]() 个NO
个NO![]() 。?
。?
(12)1 mol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-共![]() 个。?
个。?
(13)![]() 。?
。?
(14)![]() 个阳离子。?
个阳离子。?
(15)![]() 。?
。?
(16)电解精炼铜时转移0.1![]() 个电子时阳极溶解
个电子时阳极溶解
(17)![]() 个图3-1所示的结构单元。
个图3-1所示的结构单元。
图3-1
???????
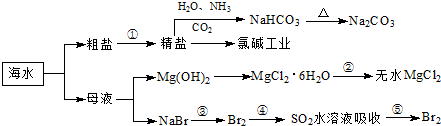
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
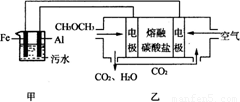
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式: 。
③已知常温下Kap[Fe(OH)3]=4.0×10—38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10—8、K2=1.1×10—12;H2CO3的电离平衡常数:K1=4.31×10—7、K2=5.61×10—11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2—+H2O=CO32—+H2S
B.发生反应的离子方程式为:CO2+S2—+H2O=HCO3—+HS—
C.c(Na+)=2[c(H2S)+c(HS—)+c(S2—)]
D.c(Na+)+c(H+)=2c(CO32—)+2c(S2—)+c(OH—)
E.c(Na+)>c(HCO3—)>c(HS—)>c(OH—)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com