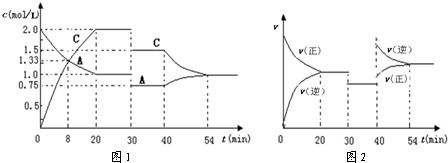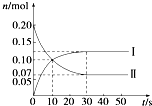
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O
2混合发生反应:2NO+O
2?2NO
2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
(1)30s时反应达到平衡,用O
2表示达到平衡过程的平均反应速率为
0.0022mol?L-1?s-1
0.0022mol?L-1?s-1
,图象中曲线
II
II
(选填“Ⅰ”或“Ⅱ”)表示NO
2的变化.由图象中曲线和数据变化,能否计算该温度下的平衡常数:
不能
不能
(填“能”或“不能”).
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO
2),则该反应是
放
放
热反应(选填“吸”或“放”).
(3)在800℃时,若缩小容器的体积,达新平衡时n(NO)
<
<
(选填“>”、“=”或“<”)0.07mol,NO的转化率
增大
增大
(选填“增大”、“不变”或“减小”).
(4)上述800℃时的反应达到平衡时测得放出热量a kJ.试写出在此条件下NO与氧气反应的热化学方程式
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
.

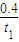 mol?L-1?min-1
mol?L-1?min-1 在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.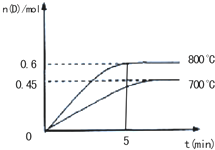 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)