
题目列表(包括答案和解析)
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
4- 4 |
甲烷和新戊烷的一氯代物都只有一种,观察两者的结构,可将新戊烷视为CH4上的四个H被甲基取代后的产物,这样在空间处于一种对称的结构。与之相似还有一系列具有这种结构的烷烃,都可将其视为将前一个烷烃上的氢原子全部被甲基取代后所得的产物,随着碳原子个数的增加,最终在空间形成一种“球状”结构。填写下列空白:
(1)该系列烷烃依次为:①CH4、②C5H12、③ 、④……
(2)随着该系列中碳原子个数的增加,C%(含碳量)的变化是
(填写“增大”“减小”“不变”),最终含量值趋向 。
(3)请写出该系列碳原子数在200以内的相对分子质量最大烷烃的分子式
物质A中只含有C、H、O三种元素,能发生银镜反应.物质C的相对分子质量为104.A与其他物质之间的转化关系如下图所示:
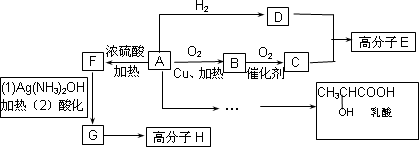
已知:(1)有机物之间的转化关系以及转化过程相对分子质量变化如下:
物质转化关系:RCH2OH RCHO RCOOH
相对分子质量:M M-2 M+14
(2)RCH![]() CH2+HBr
CH2+HBr![]() RCH(Br)CH3
RCH(Br)CH3
回答下列问题:
(1)H结构简式_______________.
(2)一定条件下B发生银镜反应的化学方程式为:_______________.
(3)C、D在一定条件下反应还能生成八元环状物,其化学反应方程式为_______________.
(4)在有机合成中,很多复杂的有机物都是从碳原子数小于或等于4有机物合成的.其中有机物F可以从甲烷合成得到,他的第一步反应是甲烷与氯气的取代反应,若此反应理论上欲获得最多的氯化氢,设V(Cl2)/V(CH4)=x,则x的取值范围是________.
(5)请设计合理方案从A合成乳酸(用反应流程图表示,并注明反应条件).
例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]()
![]()
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.SO2和O3、PO43—和C1O4—互为等电子体
B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变
C.Ti原子的核外电子排布式为[Ar]3d34s2
D.CS2、H2O、C2H2都是直线型分子
E.CH4、BCl3、CO2都是含有极性键的非极性分子
(II)(14分)
立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
(2)下图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3
(只要求列出算式)。

(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因
。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请在上方的方框中画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.SO2和O3、PO43—和C1O4—互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线型分子 |
 是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com