
题目列表(包括答案和解析)
Fenton法常用于处理含难降解有机物的工业废水.通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表)设计如下对比实验.
(1)请完成以下实验设计表(将表中序号处应填内容).
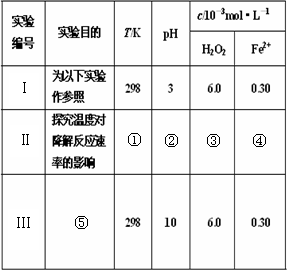
①________ ②________ ③________ ④________ ⑤________
(2)实验测得p-CP的浓度随时间变化的关系如图所示.
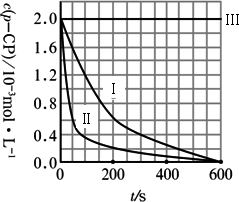
A.请根据图实验Ⅰ曲线,计算降解反应在50-300 s内的平均反应速率v(p-CP)=________,以及300 s时p-CP的降解率为________;
B.实验Ⅰ、Ⅱ表明温度升高,降解反应速率________(填“增大”、“减小”或“不变”);
C.实验Ⅲ得出的结论是:pH=10时,________;
(3)可通过反应Fe3++SCN_![]() Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN-)=0.1 mol/L,c[Fe(SCN)2+]=0.68 mol/L,则此温度下该反应的平衡常数K=________.
Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN-)=0.1 mol/L,c[Fe(SCN)2+]=0.68 mol/L,则此温度下该反应的平衡常数K=________.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)-4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是________.
A、增加C的物质的量
B、加压
C、升温
D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈________性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO![]() 水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
________________
(3)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化.如图所示.则图中表示醋酸溶液中pH变化曲线的是________
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1________m2(选填“<”、“=”、“>”)
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)![]() 4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
①增加C的物质的量
②加压
③升温
④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________
(填“A”或“B”).设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2.则m1________m2(选填“<”、“=”、“>”)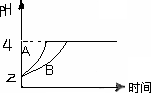
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com