
题目列表(包括答案和解析)
(8分)写出下列反应的化学方程式或离子方程式:
(1)工业用电解法制取氯气(离子方程式):
(2)漂白粉直接撒到空气中消毒(化学方程式):
(3)过量的二氧化碳通入到偏铝酸钠溶液中(化学方程式):
(4)二氧化硫使氯水褪色(化学方程式):
(8分)写出下列反应的化学方程式或离子方程式:
(1)工业用电解法制取氯气(离子方程式):
(2)漂白粉直接撒到空气中消毒(化学方程式):
(3)过量的二氧化碳通入到偏铝酸钠溶液中(化学方程式):
(4)二氧化硫使氯水褪色(化学方程式):
(8分)写出下列反应的化学方程式或离子方程式:
(1)工业用电解法制取氯气(离子方程式):
(2)漂白粉直接撒到空气中消毒(化学方程式):
(3)过量的二氧化碳通入到偏铝酸钠溶液中(化学方程式):
(4)二氧化硫使氯水褪色(化学方程式):
(10分)为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中。下图是本实验所需的仪器和药品:图中A.B.C.D.E.F分别表示玻璃导管或仪器接口。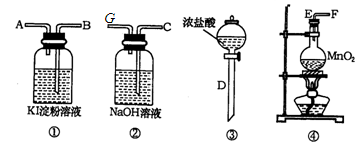
请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号);D从E处插入烧瓶后,_____________接_____________,_____________接_____________。
(2)写出制备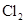 的反应方程式:______ 。
的反应方程式:______ 。
某学生用含0.4molHCl的浓盐酸和足量MnO2反应制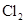 得到的
得到的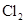 总小于
总小于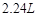 (标况下)为什么?___________________
(标况下)为什么?___________________
(3)实验完成后,装置1中的溶液为_____________色,再向其中滴加足量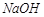 溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
(4)工业上,可用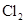 制备漂白粉,请写制备漂白粉的离子反应方程式:
制备漂白粉,请写制备漂白粉的离子反应方程式:
____________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com