
题目列表(包括答案和解析)
已知下列数据:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 |
| 338 | 1.84 |


实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛15mL饱和Na2CO3溶液(加入1滴酚酞试液)试管上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)写出CH3COOH和CH3CH218OH反应的化学方程式_____
浓H2SO4的作用是__ _ ____ __
(2)步骤③中,用小火加热试管中的混合液,其原因___ _____
(3)步骤④所观察到的现象是______ ___
(4)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出。
(5)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置更合理,为什么?
答:
已知下列数据:
|
物 质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
乙 醇 |
-114 |
78 |
0.789 |
|
乙 酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
|
浓H2SO4 |
|
338 |
1.84 |


实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛15mL饱和Na2CO3溶液(加入1滴酚酞试液)试管上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)写出CH3COOH和CH3CH218OH反应的化学方程式_____
浓H2SO4的作用是__ _ ____ __
(2)步骤③中,用小火加热试管中的混合液,其原因___ _____
(3)步骤④所观察到的现象是______ ___
(4)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出。
(5)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置更合理,为什么?
答:
已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
乙 醇 | -114 | 78 | 0.789 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 |
| 338 | 1.84 |

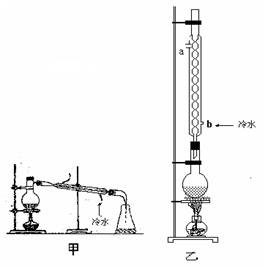
实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是___ ______。
(2)写出该反应的化学方程式_____ _ ___,浓H2SO4的作用是__ _ ____ __。
(3)步骤③中,用小火加热试管中的混合液,其原因与结论____ _____。
(4)步骤④所观察到的现象是_______________________________________________,写出原因是_____________________________________________________________________
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出,因为__________________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?
答: 。
已知下列数据:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
|
浓H2SO4 |
|
338 |
1.84 |
实验室制乙酸乙酯的主要装置如下图(a)所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按(a)图连接装置,使产生的蒸气经导管通到15ml试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处;
③小火加热试管中的混合液;
④待小试管中收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是
(2)写出该反应的化学方程式________,浓H2SO4的作用是________。
(3)步骤③中,用小火加热试管中的混合液,其原因是________。
(4)步骤④所观察到的现象是________,写出原因与结论:________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从________口倒出,因为________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答________。
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
|
浓H2SO4 |
|
338 |
1.84 |
实验室制乙酸乙酯的主要装置如下图(a)所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按(a)图连接装置,使产生的蒸气经导管通到15ml试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处;
③小火加热试管中的混合液;
④待小试管中收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是
(2)写出该反应的化学方程式________,浓H2SO4的作用是________。
(3)步骤③中,用小火加热试管中的混合液,其原因是________。
(4)步骤④所观察到的现象是________,写出原因与结论:________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从________口倒出,因为________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com