
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
Ⅰ定性研究亚硫酸钠被氧化的程度
假设1:亚硫酸钠未被氧化;假设2:亚硫酸钠完全被氧化
假设3:
亚硫酸钠部分被氧化
亚硫酸钠部分被氧化
;
请设计实验方案证明假设3成立的操作步骤及实验现象
取少量亚硫酸钠样品滴加过量BaCl2,再滴加稀盐酸,若能产生白色沉淀,滴加盐酸后白色沉淀部分溶解,则可证明(或取少量亚硫酸钠样品,滴加过量稀盐酸后,再滴加BaCl2溶液,若开始有无色刺激性气体产生,后滴加有白色沉淀,则可证明)
取少量亚硫酸钠样品滴加过量BaCl2,再滴加稀盐酸,若能产生白色沉淀,滴加盐酸后白色沉淀部分溶解,则可证明(或取少量亚硫酸钠样品,滴加过量稀盐酸后,再滴加BaCl2溶液,若开始有无色刺激性气体产生,后滴加有白色沉淀,则可证明)
Ⅱ定量研究亚硫酸钠被氧化的程度
根据某同学设计的如下图装置回答下面的问题:
(1)B装置中反应的离子方程式为
Cl2+SO2+2H2O=4H++2Cl-+SO42-
Cl2+SO2+2H2O=4H++2Cl-+SO42-
.
(2)称量ag Na
2SO
3样品放入锥形瓶中,待A、B装置中都反应完全后,向B装置反应后的溶液中加入足量的BaCl
2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na
2SO
3的质量分数为
.某同学认为上述实验设计中存在一明显不足,不足之处为
残留在装置中的SO2没有被氧化
残留在装置中的SO2没有被氧化
.

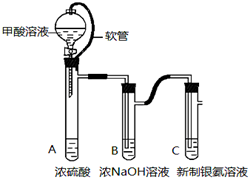 银氨溶液可用于检测CO气体.实验室研究该反应的装置图如图:
银氨溶液可用于检测CO气体.实验室研究该反应的装置图如图: 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: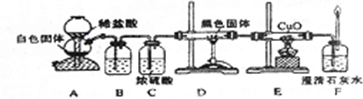
 .
.