
题目列表(包括答案和解析)
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)的
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.Mg可由电解熔融MgO制取,Na也可由电解熔融NaCl制取
D.铝热法还原铁的反应中,放出的热量能使铁熔化
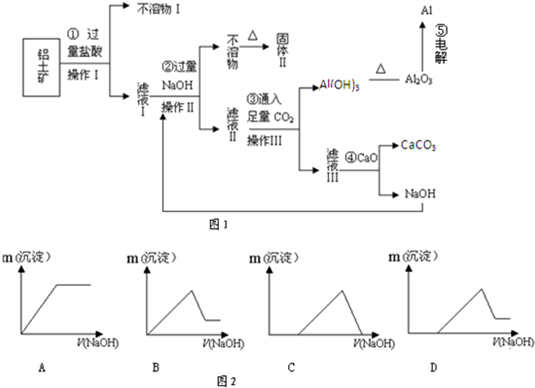
(12分)电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图
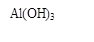
(1)固体Ⅱ的化学式为_ ,该固体的颜色为 ;
(2)在实际工业生产流程⑤中需加入冰晶石,目的是 ;
(3)写出流程③的离子方程式 ;
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是 ;
A.复分解反应 B.氧化还原反应 C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有_ _;
(7)若向滤液Ⅰ中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com