A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y
2X
2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为
; Z在周期表中的位置是
第三周期ⅥA族
第三周期ⅥA族
;B元素的名称为
碳
碳
.
(2)化合物Y
2X
2的电子式为
;它含有的化学键类型有
A、C
A、C
(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为
H2O2+H2S=S↓+2H2O
H2O2+H2S=S↓+2H2O
.
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入
氧气
氧气
(填物质名称);负极电极反应式为
H2-2e-+2OH-═2H2O
H2-2e-+2OH-═2H2O
.
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发又较低经济的制氢方法是
③
③
(填写编号)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是
氢气的液化、氢气的安全储存等
氢气的液化、氢气的安全储存等
.(写出其中的一个)





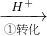 Cr2O72-
Cr2O72-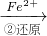 Cr3+
Cr3+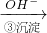 Cr(OH)3↓
Cr(OH)3↓ Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓