
题目列表(包括答案和解析)
下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
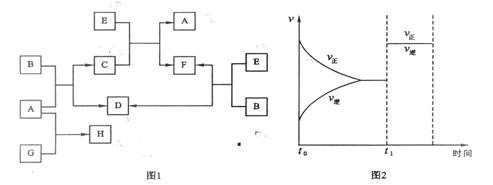
(1)E和N2是等电子体(原子数相同、电子数均相同、结构相似),请写出可能E的电子式: 。
(2)若G是一种淡黄色固体单质,在通常情况下16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
(3)若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;请说明H的水溶液止血的原理
。将过量F通入NaOH得到的溶液再与H溶液反应的离子方程式为 。
(4)在101kPa和150℃时,可逆反应E(g) + B(g)![]() F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
A.升高温度 B.增大压强 C.加入催化剂 D.将B、E的浓度均增加1倍
| 4 |
| a2 |
| 4 |
| a2 |
| △ |
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com