
题目列表(包括答案和解析)
0.1 mol/L的CH3COOH溶液达到电离平衡时( )
A. c(CH3COO― ) = c( H+ ) B. c(CH3COOH) = 0.1mol/L
C. c(CH3COOH) < c(CH3COO― ) D. c(H+) = c(OH― )
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COOH)?c(OH-) |
| c(CH3COO-) |
| Ka.c |
| Ka.c |
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
|
①H2SO4溶液HSO4- |
②NaHSO4溶液HSO4- |
③CH3COOH |
④HCl溶液 |
|
10% |
29% |
1.33% |
100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
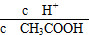 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.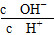
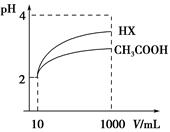
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com